导读:2024年基因编辑疗法领域异象频出!从诺和诺德的三个月3笔加注,以及Ascidian公司与罗氏(Roche)约18亿美元针对神经疾病的RNA外显子编辑疗法的研究合作与许可协议,再到RNA编辑疗法在临床试验中的首次成功实现,医药巨头对于愈显潜力的基因编辑疗法兴趣愈发浓厚,相关数据显示2024年前三季度全球在基因编辑疗法领域达成的合作交易已达10起,涉及金额超13亿美元。
DNA编辑
基因编辑是指通过特定的生物技术手段,对生物体的基因组中的特定基因序列进行精确的添加、删除或替换,以实现对基因功能的定向改变。这种技术允许科学家们对生物的遗传质进行精确的修改,以研究基因功能、治理遗传疾病或改良作物品种等。
自1987年Thompsson等建立起完整的ES细胞基因敲除小鼠模型依赖,基因编辑技术已经经过了几十年的发展,从最早的同源重组技术(HR)到人工介导的锌指核酸酶技术(ZFNs)、再到近年来大热的规律成簇的间隔短回文重复相关蛋白技术(CRISPR/Cas9),基因编辑技术得到快速发展。
图表1:基因编辑技术对比
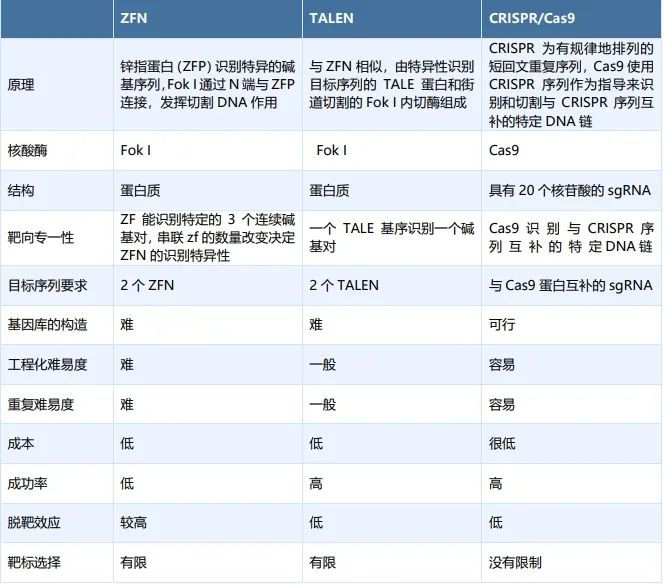
ZFNs(锌指核酸酶)是第一个普遍使用的基因编辑技术,其通过锌指蛋白精确识别并结合到目标序列,随后激活与之融合的核酸内切酶FokI,形成二聚体并切割DNA双链,随后通过细胞内的DNA修复机制实现基因的敲除或特定位置的基因插入。由于针对不同的DNA序列需要设计不同的锌指结构,较为耗时费力,且由于识别位点较短,存在一定的脱靶显像,并未大规模应用于基因编辑治疗。
TALEN技术通过由特定重复序列组成的TALE蛋白精确识别目标DNA序列,并利用与之融合的核酸内切酶FokI在特定靶点出切割DNA双链,与ZFNs技术相比具有特异性较高,识别准确的特定,但针对不同序列同样需要重新开发TALE结构,较为耗时耗力。
CRISPR/Cas9技术是基因编辑领域的革命性技术,与ZFNs以及TALEN相比在设计和构建上更为简单,能实现高度灵活性和特异靶向性,可直接在细胞中对基因序列进行更改,由非编码短向导RNA(gRNA)和Cas9核酸酶组成。
CRISPR/Cas9的运作机制是gRNA单元将Cas9蛋白引导至特定基因组位点,Cas9核酸酶在该位点进行切割形成DNA双链断裂(DSB),再根据目的的不同运用同源修复(HDR)以及非同源性末端接合(NHEJ)两种内源性DNA修复机制完成对目标DNA序列的编辑。其中NHEJ基于其本身的“随机性”可以帮助研究人员进行直接、高效的基因敲除操作,HDR则可以依据特定的基因模板对序列进行基因敲入、替换操作。发展至今,CRISPR技术已经成为目前最便捷、应用最广泛的基因编辑工具。
基因编辑疗法的治疗机制主要分为体外和体内两大类,前者涉及从患者体内获取细胞(如造血干细胞或T细胞),在体外进行基因编辑,然后将编辑过的细胞重新注入患者体内;后者采用递送载体装载基因编辑工具递送至患者体内特定组织与器官,完成治疗。
基因疗法凭借其在罕见病中卓越的临床数据愈发受到各大医药巨头关注,据凯莱英药闻不完全统计,目前全球在研的基因编辑疗法约300种,其中仅CRISPR/Cas9基因编辑疗法Casgevy(适应症为Beta地中海贫血和镰状细胞性贫血)获批;2024年前三季度全球基因编辑疗法领域共发生10笔交易,累计超13亿美元。据Statista统计,2023年全球基因编辑行业市场规模达到66.19亿美元,预计至2030年市场规模将增至360.61亿美元。
RNA编辑
RNA编辑是基因编辑疗法中的一种,不同于以CRISPR/Cas9为主流的DNA编辑疗法,RNA编辑是在RNA水平上对基因进行编辑修复。相对于DNA编辑,RNA编辑是一种瞬时、可逆的编辑,被认为具有更高的安全性。
2024年10月16日,WaveLifeSciences公布了WVE-006治疗α-1抗胰蛋白酶缺乏症(AATD)的Ib/IIa期RestorAATion-2研究的积极机制证明数据。AATD是一种由SERPINA1基因突变引起的遗传性疾病,主要病理特点时突变型AAT蛋白的积累。患者通常表现出进行性肺损伤、肝损伤,导致频繁住院和潜在致命的肺部疾病或/和肝脏疾病。
RNA编辑技术的基本原理是通过特定的酶或编辑因子,对信使RNA(mRNA)上的碱基进行修改,从而影响蛋白质的合成,可以分为单碱基编辑和RNA外显子编辑两种类型。相比于一旦发生脱靶效应则无法逆转的DNA编辑,RNA编辑只暂时改变基因的表达,并不改变基因,可以避开直接修改DNA所引发的伦理和安全问题。
单碱基编辑是指利用人体细胞中天然存在的作用RNA的腺苷脱氨酶(ADAR)将RNA序列中的腺嘌呤碱基交换为后续会翻译为鸟嘌呤的肌苷碱基实现对碱基的转换,此次WaveLifeSciences针对AATD开发的单碱基编辑疗法WVE-006便是基于此原理,通过引导ADAR酶对特定mRNA上的错配碱基进行精准编辑,纠正导致AAT蛋白功能失调的基因突变。
外显子中出现突变可能会导致异常蛋白的产生,RNA外显子编辑是利用RNA剪接过程,去除含有突变的外显子,并用健康的外显子取代他们。与只修改一个RNA碱基的单碱基编辑不同,RNA外显子编辑能够一次性改变RNA分子中成千上万的一串字母,将导致疾病的RNA序列替换为功能正常的RNA序列。
采用RNA外显子编辑技术路线的是AscidianTherapeutics公司,今年1月,Ascidian公司拟用于Stargardt并和其他ABCA4基因相关视网膜病的首款RNA外显子编辑疗法ACDN-01的IND申请获得美国FDA的许可,并被授予快速通道资格。
今年6月,Ascidian公司宣布与罗氏(Roche)达成一项总额高达约18亿美元的研究合作与许可协议,共同发现和开发针对神经疾病的RNA外显子编辑疗法,叠加诺和诺德在RNA编辑领域的布局消息,越来越多医药巨头开始在该赛道中进行押注。
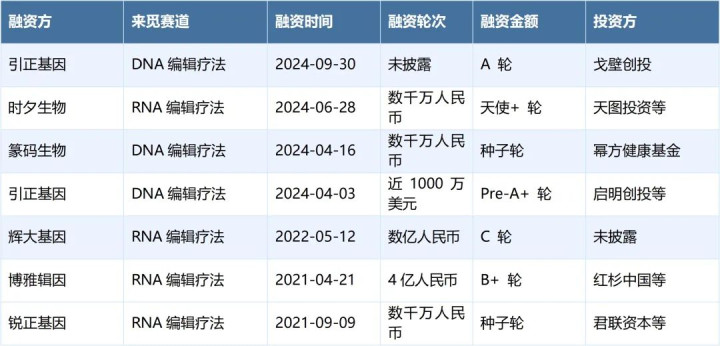
伴随着近年来海内外基因疗法临床疗效取得的巨大成功,基因治疗、基因编辑疗法作为创新疗法中的新星受到越来越多的关注及加注,从国内基因编辑疗法的一级市场投融动态来看,近年来已有多家专注于DNA编辑疗法以及RNA编辑疗法的企业获得过融资。感兴趣的读者,可以登录RimePEVC平台获取基因编辑疗法赛道全量融资案例、被投项目及深度数据分析。
图表2:近年来中国基因编辑疗法领域投融情况